Готовые материалы для тестирования Демоверсия ОГЭ по химии 2019 года с ответами
Часть 1
Ответом к заданиям 1–15 является одна цифра, которая соответствует номеру правильного ответа.
1. На данном рисунке
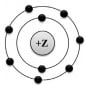
изображена модель атома
1) хлора
2) азота
3) магния
4) фтора
2. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ?
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
3. В молекуле фтора химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
4. В каком соединении степень окисления азота равна +3?
1) Na3N
2) NH3
3) NH4Cl
4) HNO2
5. Вещества, формулы которых – ZnO и Na2SO4, являются соответственно
1) оснόвным оксидом и кислотой
2) амфотерным гидроксидом и солью
3) амфотерным оксидом и солью
4) оснόвным оксидом и основанием
6. Признаком протекания химической реакции между оксидом меди и водородом является
1) появление запаха
2) изменение цвета
3) выпадение осадка
4) выделение газа
7. Одинаковое число молей катионов и анионов образуется при полной диссоциации в водном растворе 1 моль
1) H2SO4
2) (NH4)2S
3) BaCl2
4) CuSO4
8. Газ выделяется при взаимодействии
1) MgCl2 и Ba(NO3)2
2) Na2CO3 и CaCl2
3) NH4Cl и NaOH
4) CuSO4 и KOH
9. Не реагируют друг с другом
1) хлор и водород
2) кислород и кальций
3) азот и вода
4) железо и сера
10. Оксид алюминия реагирует с каждым из двух веществ:
1) Na2O и H2O
2) SiO2 и Ag
3) NaOH и HCl
4) HNO3 и O2
11. В реакцию с соляной кислотой вступает
1) нитрат серебра
2) нитрат бария
3) серебро
4) оксид кремния
12. Среди веществ: NaCl, Na2S, Na2SO4 – в реакцию с раствором Cu(NO3)2 вступает(-ют)
1) только Na2S
2) NaCl и Na2S
3) Na2S и Na2SO4
4) NaCl и Na2SO4
13. Верны ли суждения о безопасном обращении с химическими веществами?
А. Разбитый ртутный термометр и вытекшую из него ртуть следует выбросить в мусорное ведро.
Б. Красками, содержащими соединения свинца, не рекомендуется покрывать детские игрушки и посуду.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
14. Сера является окислителем в реакции
1) H2S + I2 = S + 2HI
2) 3S + 2Al = Al2S3
3) 2SO2 + О2 = 2SO3
4) S + 3NO2 = SO3 + 3NO
15. На какой диаграмме распределение массовых долей элементов отвечает количественному составу фосфата аммония?
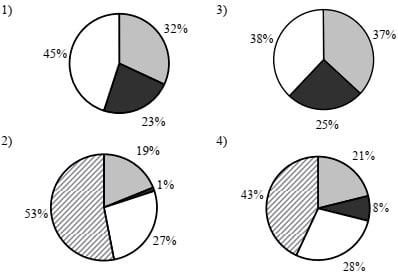
Ответом к заданиям 16–19 является последовательность цифр.
При выполнении заданий 16, 17 из предложенного перечня ответов выберите два правильных.
16. Общим для магния и кремния является
1) наличие трёх электронных слоёв в их атомах
2) существование соответствующих им простых веществ в виде двухатомных молекул
3) то, что они относятся к металлам
4) то, что значение их электроотрицательности меньше, чем у фосфора
5) образование ими высших оксидов с общей формулой ЭО2
17. Для этанола верны следующие утверждения:
1) в состав молекулы входит один атом углерода
2) атомы углерода в молекуле соединены двойной связью
3) является жидкостью (н.у.), хорошо растворимой в воде
4) вступает в реакцию со щелочными металлами
5) сгорает с образованием угарного газа и водорода
При выполнении заданий 18, 19 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
18. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Вещества
А) Na2CO3 и Na2SiO3
Б) К2CO3 и Li2CO3
В) Na2SO4 и NaOH
Реактив
1) CuCl2
2) HCl
3) MgO
4) K3PO4
19. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Названия вещества
А) сера
Б) оксид цинка
В) хлорид алюминия
Реагенты
1) CO2, Na2SO4(р-р)
2) HCl, NaOH(р-р)
3) AgNO3(р-р), KOH(р-р)
4) H2SO4(конц.), О2
Часть 2
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI + H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель.
21. 170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия. Выпал осадок массой 8,61 г. Вычислите массовую долю соли в растворе нитрата серебра.
22. Даны вещества: FeCl3, H2SO4(конц.), Fe, Cu, NaOH, CuSO4.
Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа(II).
Запишите уравнения проведённых химических реакций. Опишите признаки этих реакций. Для реакции ионного обмена напишите сокращённое ионное уравнение реакции.
Ответы на демоверсию ОГЭ по химии 2019 года
1-4
2-1
3-3
4-4
5-3
6-2
7-4
8-3
9-3
10-3
11-1
12-1
13-2
14-2
15-4
16-14
17-34
18-241
19-423
20.
1) Составляем электронный баланс:
1 | S+6 + 8ē → S–2
4 | 2I–1 – 2ē → I20
2) Расставляем коэффициенты в уравнении реакции:
8HI + H2SO4 = 4I2 + H2S + 4H2O
3) Указываем, что сера в степени окисления +6 является окислителем, а иод в степени окисления –1 – восстановителем
21.
1) Уравнение реакции:
AgNO3 + NaCl = AgCl + NaNO3
2) Расчет количества вещества и массы нитрата серебра, содержащегося в исходном растворе:
по уравнению реакции n(AgNO3) = n(AgCl) = m(AgCl) / M(AgCl) = 8,61 / 143,5 = 0,06 моль
m(AgNO3) = n(AgNO3) · M(AgNO3) = 0,06 · 170 = 10,2 г
3) Вычисление массовой доли нитрата серебра в исходном растворе:
ω(AgNO3) = m(AgNO3) / m(р-ра) = 10,2 / 170 = 0,06, или 6%
22.
Составляем два уравнения реакции:
1) Fe + CuSO4 = FeSO4 + Cu
2) FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4
Описываем признаки протекания реакций:
3) для первой реакции: выделение красного осадка металлической меди и/или изменение окраски раствора;
4) для второй реакции: выпадение серо-зелёного осадка.
Составляем сокращённое ионное уравнение второй реакции:
5) Fe2+ + 2OH– = Fe(OH)2
